TS.Nguyễn Thị Xuân Hồng, TS.Trương Thị Hoa, TS.Nguyễn Thị Huế Linh, PGS.TS.Ngô Hữu Toàn - Khoa Thuỷ sản - Trường ĐH Nông Lâm, ĐH Huế
Giới thiệu
Nuôi trồng thuỷ sản (NTTS) là lĩnh vực sản xuất thức ăn hứa hẹn nhất, cung cấp nguồn thức ăn giàu protein cho con người và vật nuôi trên toàn thế giới. Sản lượng nuôi trồng thuỷ sản không ngừng gia tăng vượt bậc trong 10 năm trở lại đây, tổng sản lượng NTTS đạt 110,2 triệu tấn tương đương với giá trị ước tính là 243,5 tỷ USD trong năm 2016 [1]. Tôm nuôi là đối tượng thương mại chủ lực nhất với hai loài phổ biến là tôm sú (Panaeus monodon) và tôm thẻ chân trắng (Panaeus vannamei) chiếm 80% tổng sản lượng tôm nuôi trên thế giới.
Kỹ thuật nuôi trồng tiên tiến với mât độ nuôi cao, sử dụng thức ăn viên công nghiệp nhằm tăng sản lượng nuôi trồng đã làm mất cân bằng hệ sinh thái môi trường nước dẫn đến sự gia tăng của dịch bệnh. Dịch bệnh trong NTTS đang là một trong những thách thức lớn nhất ảnh hưởng đến sản lượng và hiệu quả nuôi trồng. Bệnh trên tôm nuôi gây ra bởi các tác nhân khác nhau như vi rút, vi khuẩn, kí sinh trùng, nấm…Điều kiện dẫn đến dịch bệnh trên tôm nuôi phụ thuộc vào sự có sẵn của tác nhân gây bệnh, chất lượng môi trường nước và sức khoẻ của tôm nuôi.
Bệnh vi bào tử trùng trên gan tuỵ (HPM) đã được báo cáo trên tôm sú (P. monodon) nuôi tại Thái Lan vào năm 2003 [2]. Tôm nuôi bị bệnh HPM thường có hội chứng chậm lớn và thường đi kèm với việc nhiễm bệnh do các tác nhân cơ hội như Vibrio, MBV, HPV. Những năm sau đó, vi bào tử trùng này được xác định là Enterocytozoon heparopenaei (EHP) và được phân lập trên tôm sú [3] và trên tôm thẻ chân trắng [4] nuôi ở các nước Đông Nam Á như Trung Quốc, Indonesia, Malaysia, Việt Nam, Thái Lan và Ấn Độ. Năm 2010, EHP được ghi nhận trên tôm sú nuôi bị hội chứng phân trắng (WFS) ở Việt Nam [5].
Tôm bệnh do vi bào tử trùng được biết với tên tiếng anh là “cotton shrimp” (tôm bông gòn) hoặc “milky shrimp” (tôm sữa). Vi bào tử trùng là những ký sinh trùng nội bào bắt buộc chúng có thể gây nhiễm trên tất cả động vật bao gồm động vật có xương sống và động vật không xương sống. Vi bào tử trùng thực hiện quá trình nhân lên trong tế bào chất của các ống gan tuỵ bị nhiễm bệnh. Đây là bệnh mới nổi gây ảnh hưởng lớn trên tôm thẻ chân trắng nuôi ở Việt Nam, Trung Quốc, Thái Lan, Ấn Độ và Malaysia.
Vi bào tử trùng Microsporidia tạo thành một nhóm ký sinh trùng nhân thật đơn bào hình thành bào tử. Chúng từng được xem là nguyên sinh động vật hoặc protists nhưng ngày nay chúng được mô tả là nấm . Vi bào tử trùng được biết đến từ 150 năm trước bao gồm 1300 đến 1500 loài trong đó có187 loài đã được mô tả. Vi bào tử trùng Microsporidia là những kí sinh trùng nội bào bắt buộc với chu kỳ sống tương đối đồng nhất [6].
Vi bào tử trùng không có cơ quan di động như tiêm mao và có khả năng sinh ra những bào tử có khả năng đề kháng cao, có thể sống sót bên ngoài ký chủ lên đến vài năm. Đặc điểm hình thái của bào tử thường có ý nghĩa trong việc phân biệt sự khác nhau giữa các loài. Bào tử của EHP có hình oval có kích thước 1,0 – 1,7 micromet.
EHP là vi bào tử trùng hình thành bào tử bắt buộc, nhiều nghiên cứu đã xác nhận EHP gây nhiễm tế bào gan tuỵ bằng cách thay đổi các chỉ số hoá sinh của chúng như protein tổng số, albumin, aspartate transaminase (AST) và alkaline phosphatase – hai enzyme chỉ thị cho sự tổn thương của tế bào [7] và những chỉ số này giúp hiểu rõ hiện trạng chức năng của gan tuỵ trên tôm nhiễm EHP.
Phân bố và con đường lan truyền
Vi bào tử trùng là những kí sinh trùng phổ biến đã được báo cáo từ nhiều nước khác nhau. Vi bào tử trùng EHP đã được xác nhận là kí sinh trùng kí sinh nội bào bắt buộc, quá trình sinh sản được tiến hành bên trong tế bào chất của tế bào ống gan tuỵ và có khả năng truyền bệnh theo chiều ngang bởi hiện tượng ăn thịt lẫn nhau, chỉ có ở tôm. Mặc dù lây truyền theo chiều ngang là con đường lây truyền chính của vi bào tử trùng thông qua môi trường nước giữa các vi bào tử trùng thuỷ sinh [8], nhiều loài sử dụng cả hai con đường lây truyền theo chiều ngang và chiều dọc [9]. Việc sử dụng thức ăn tươi sống trong nuôi tôm là nguy cơ dẫn đến rủi ro lây nhiễm EHP sang tôm nuôi. Thức ăn tươi sống nhiễm vi bào tử trùng có thể lan truyền và gây nhiễm EHP thông qua phân [10], EHP cũng có thể lan truyền trực tiếp giữa tôm nuôi với nhau trong ao thông qua môi trường nước [8][11].
Dấu hiệu bệnh lý
Tôm nuôi nhiễm EHP thường không có dấu hiệu bệnh lý rõ ràng. Khi tôm giống bị nhiễm EHP thả nuôi trong tháng đầu tiên, tôm vẫn phát triển tương đối bình thường nhưng sau khi tôm đạt trọng lượng 3-4g/con, cũng như khối lượng tôm trong ao tăng dần thì tôm chậm lớn dần rồi có thể dừng lớn hẳn. Dấu hiệu bênh lý điển hình của tôm nhiễm vi bào tử trùng là hiện tượng tôm chậm lớn và nhiều phần trên cơ thể chuyển sang màu trắng đục. Ao tôm bị bệnh có hiện tượng lệch size ở tôm nuôi. Trong giai đoạn đầu, tôm nhiễm vi bào tử trùng thường có hiện tượng mềm vỏ, chết rải rác, giảm ăn và rỗng ruột.
.png)
Hình 1: Mẫu gan tôm khoẻ (A) và tôm nhiễm EHP (B) thu tại Phong Điền
Một số nghiên cứu trước đây cho rằng hội chứng phân trắng (WFS) và sự phân size là những dấu hiệu bệnh lý chính của EHP [12][8]. EHP chỉ gây nhiễm tế bào ống của gan tuỵ ở tôm và làm ảnh hưởng đến khả năng hấp thu dinh dưỡng từ thức ăn của gan tuỵ tôm. EHP không gây chết trên tôm nuôi nhưng gây ra hiện tượng chậm lớn. Một số trường hợp nhiễm EHP có thể làm tôm nhạy cảm hơn đối với các bệnh nhiễm khuẩn như Vibrio spp. từ đó dẫn đến hiện tượng tôm chết ở các ao nuôi nhiễm EHP. Kết quả kiểm tra mẫu gan tuỵ của tôm thẻ chân trắng dương tính với EHP ở Phong Điền, Thừa Thiên Huế cho thấy ống gan tuỵ bị biến dạng, số lượng giọt dầu trong gan ít (Hình 1B).
Thay đổi bệnh lý
Về mặt mô học, hiện tượng hoại tử nghiêm trọng có thể quan sát thấy trên gan tuỵ tôm. Những thay đổi bệnh lý phổ biến liên quan đến EHP được quan sát thấy trên mẫu gan tuỵ tôm (Hình 2). Sự lớn lên của bạch cầu ưa axit, bạch cầu ưa kiềm chỉ ra các giai đoạn phát triển giả định của EHP trong biểu mô ống gan tuỵ. Những thay đổi phổ biến này được quan sát thấy ở đoạn cuối của ống gan tuỵ và cho thấy biểu mô ống tách rời từ màng đáy của tế bào gan tuỵ (Hình 2C). Phần cơ bản của biểu mô ống có các hạt và sự xuất hiện của các bào tử (Hình 2B), sự bong tróc của các tế bào biểu mô ống dễ dàng nhìn thấy do gan tụy bị nhiễm bệnh nặng và bởi tế bào bị tổn thương nghiêm trọng (Hình 2C;D)
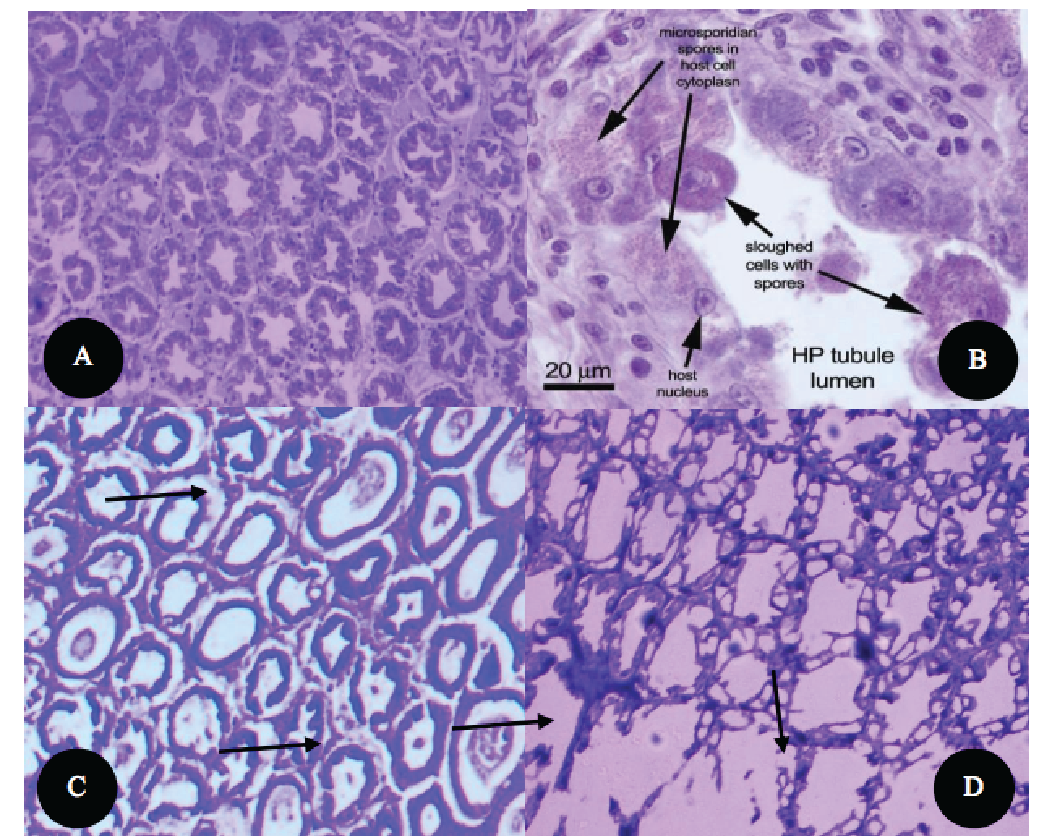
Hình 2: Sự thay đổi mô học của tôm chân trắng nhiễm EHP
A. Cấu trúc bình thường của gan tuỵ B. Sự xuất hiện của bào tử và sự bong tróc của gan tuỵ,
C. Sự tách rời của ống gan tuỵ D. Sự tổn thương nghiêm trọng của tế bào [13]
Trong một số trường hợp, khi nhiễm vi bào tử trùng nhiều phần trên cơ thể tôm chuyển sang màu trắng đục hoặc trắng sữa. Khi tôm lớn dấu hiệu lâm sàng này càng rõ ràng hơn, đặc biệt ở phần lưng từ gan tuỵ đến phần giữa thân (Hình 3). Một số con có hiện tượng bị đục cơ đốt cuối cơ thể, bệnh không gây tỷ lệ chết cao trên tôm. Bên cạnh đó, vi bào tử trùng ảnh hưởng đến một số cơ quan khác như gan tuỵ và buồng trứng. Tôm nhiễm vi bào tử trùng thường có khả năng đề kháng kém và khả năng chống chịu stress kém vì vậy chúng dễ dàng bị ăn thịt và sống sót kém trong quá trình vận chuyển. Tôm cái mang trứng nhiễm vi bào tử trùng thường xảy ra hiện tượng nhiễm trùng buồng trứng và dẫn đến hiện tượng vô sinh.

Hình 3: Tôm nhiễm EHP
Những tế bào nhiễm EHP chứa plasmodia (Hình 4a) hoặc bào tử trong tế bào chất (Hình 4b). Vi bào tử trùng sử dụng dưỡng chất của tế bào để thực hiện quá trình nhân lên của mình. Quá trình này làm cạn kiệt dưỡng chất của tế bào cuối cùng dẫn đến hiện tượng vỡ và chết tế bào. Nghiên cứu của Aranguren và cs (2017) cũng kết luận rằng EHP làm tăng tính mẫn cảm của tôm nuôi đối với sự cảm nhiễm vi khuẩn Vibrio – đã đươc biết đến là những tác nhân cơ hội gây bệnh khi sức khoẻ của tôm nuôi suy giảm. EHP phá huỷ tế bào ống gan tuỵ và cho phép Vibrio spp. có sẵn kí sinh trên tế bào bong tróc và để lộ lớp màng nền của tế bào ống gan tuỵ [14].
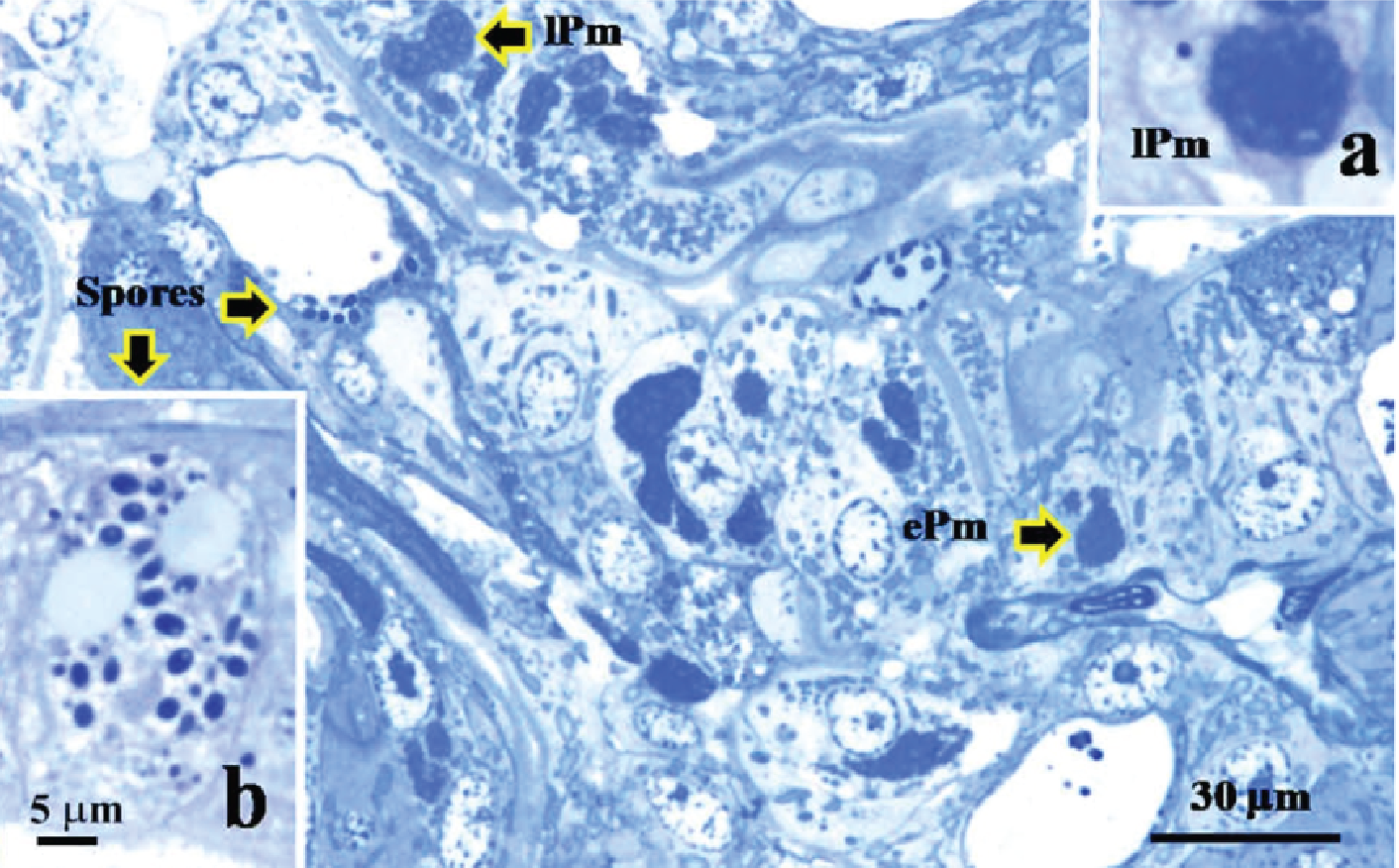
Hình 4: Biểu mô gan tuỵ nhiễm EHP (nhuộm Toluidine blue) [3]
Nhiều loài vi bào tử trùng có ký chủ cụ thể và vòng đời của phần lớn vi bào tử trùng vẫn chưa được làm rõ. Ví dụ vòng đời của vi bào tử trùng trên tôm Penaeid hiện vẫn chưa được làm rõ mặc dù chúng đã được biết đến từ lâu. Ngược lại vòng đời của Amblyspora californica – một loài vi bào tử trùng trên muỗi đã được giải thích khá phức tạp, có liên quan đến sự thay đổi 2 ký chủ và 3 giai đoạn bào tử và có thể truyền bệnh theo chiều dọc và chiều ngang.
Có mối liên hệ giữa tôm nuôi nhiễm EHP và hội chứng phân trắng (WFS), những ao nuôi phát hiện dương tính với EHP nhưng âm tính với WFS chiếm tỷ lệ 39,7% trong khi những ao nuôi dương tính đồng thời với EHP và WFS chiếm tỷ lệ 96,4% [12]. Ngoài ra, tỷ lệ nhiễm EHP còn phụ thuộc vào hình thức nuôi trồng, tỷ lệ nhiễm EHP của những ao nuôi Greenhouse (54,4%) thấp hơn tỷ lệ nhiễm EHP của ao đất (79,5%) [15].
Chẩn đoán
EHP có thể được chuẩn đoán bằng hai phương pháp: dựa vào ADN (kỹ thuật PCR và LAMP) và phương pháp kiểm tra mẫu bằng kính hiển vi (nhuộm Hematoxylin và Eosin), kính hiển vi điện tử, phương pháp lai…. Tất cả những phương pháp này có thể thực hiện bằng cách quan sát cẩn thận bào tử trong mẫu phân và biểu mô gan tuỵ bằng cách kiểm tra mẫu kính phết và mô học bằng kính hiển vi. Ngoài ra, có thể sử dụng kỹ thuật PCR, qPCR và LAMP để phát hiện nhanh chóng và chính xác EHP cho trại giống và ao nuôi. Tôm giống, tôm bố mẹ và thức ăn tươi sống nên được xét nghiệm EHP trước khi đưa vào nuôi và sử dụng để loại trừ khả năng lây nhiễm EHP trong quá trình nuôi.
Phòng và trị bệnh
Hiện nay vẫn chưa có biện pháp trị bệnh EHP cho tôm nuôi. Trên thực tế nhiều hộ nuôi tự áp dụng các biện pháp tự phát để phòng trị bệnh EHP cho tôm nuôi bằng cách bổ sung tỏi vào thức ăn nuôi tôm với tỷ lệ 30-40 g/kg thức ăn.
Ở Indonesia, người dân địa phương áp dụng việc bổ sung chế phẩm sinh học, hỗn hợp tỏi với tỷ lệ 10-20g/kg thức ăn và vitamin C (2g/kg thức ăn) nhằm phòng bệnh EHP và WFS cho tôm nuôi [16].
Một trong những phương pháp phòng bệnh tốt nhất hiện nay là áp dụng quy trình thực hành quản lý tốt và áp dụng tiêu chuẩn an toàn sinh học cho ao nuôi. Hơn thế, một khi bào tử EHP xuất hiện trong ao nuôi thì rất khó để loại trừ mầm bệnh vì vậy khuyến cáo tốt nhất để phòng bệnh là áp dụng tốt tiêu chuẩn an toàn sinh học và quy trình quản lý ao nuôi tốt như cải tạo ao nuôi trước và sau khi nuôi, xử lý nước… nhằm phòng việc lây nhiễm EHP thông qua môi trường nước và sinh vật thuỷ sinh mang bệnh. Tôm giống trước khi đưa vào nuôi cần được xét nghiệm nhằm loại trừ khả năng lây nhiễm EHP. Tránh việc sử dụng thức ăn tươi sống như giun nhiều tơ, hàu, mực… để làm thức ăn cho tôm bố mẹ hoặc thực hiện các biện pháp loại trừ mầm bệnh có khả năng lây nhiễm từ thức ăn tươi sống cho đối tượng nuôi trước khi sử dụng.
Shen và cộng sự đã khuyến cáo việc sử dụng tôm bố mẹ sạch bệnh (SPF brood stocks), áp dụng phương pháp quản lý tốt ao nuôi có thể là biện pháp chính phòng bệnh không mong muốn cho farm nuôi [15].
Tài liệu tham khảo
[1] FAO, “The state of world fisheries and aquaculture,” 2018.
[2] P. Chayaburakul, K., Nash, G., Pratanpipat, S. and W. Sriurairatana, and B., “Multiple pathogens found in growth-retarded black tiger shrimp Penaeus monodon cultivated in Thailand.,” Dis Aqua, vol. 60, no. 2, pp. 89–96, 2004.
[3] B. Tourtip, S., Wongtripop, S., Stentiford, G.D., Bateman, K.S., Sriurairatana, S., Chavadej, J., Sritunyalucksana, K., Withyachumnarnkul, “Enterocytozoon hepatopenaei sp. nov. (microsporida: Enterocytozoonidae), a parasite of the black tiger shrimp Penaeus monodon (decapoda: Penaeidae): Fine structure and phylogenetic relationships.,” J. Invertebr. Pathol, vol. 102, pp. 21–29, 2009.
[4] Tangprasittipap, A., Srisala, J., Chouwdee, S., Somboon, M., Chuchird, N., Limsuwan, C., Srisuvan, T., Flegel, T.W., Sritunyalucksana, K., “The microsporidian Enterocytozoon hepatopenaei is not the cause of white feces syndrome in whiteleg shrimp Penaeus (Litopenaeus) vannamei.,” BMC Vet. Res., vol. 139, 2013.
[5] L. V. Ha NTH, Ha DT, Thuy NT, “Enterocytozoon hepatopenaei Parasitizing on tiger shrimp (Penaeus monodon) infected by white feces culture in Vietnam, has been detected.,” Agric. Rural Dev. Sci. Technol., vol. 12, pp. 45–50, 2010.
[6] P. M. Cali, A. and Takvorian, Developmental morphology and life cycle of microsporidia. In: Wittner, M., Weiss, L.M (Eds.), the microsporidia and microsporidiosis, ASM Press, Washington, D.C.,. 1999.
[7] C. Y. H. and H. B. Pan C.H., “Alterations of antioxidant capacity and hepatopancreatic enzymes in Penaeus Monodon (Fabricius) juveniles fed diets supplemented with astaxanthin and exposed to Vibriodamsela challenge.,” J. Fish. Soc. Taiwan., vol. 30, pp. 279–290.
[8] S. Salachan, P.V., Jaroenlak, P., Thitamadee, I. O. and Sritunyalucksana, and K., “Laboratory cohabitation challenge model for shrimp hepatopancreatic microsporidiosis (HPM) caused by Enterocytozoon hepatopenaei (EHP).,” Vet. Res., vol. 13, no. 9, pp. 1–7, 2017.
[9] J. E. Dunn, A. and Smith, “Microsporidian life cycles and diversity: the relationship between virulence and transmission.,” Microbe. Infect, vol. 3, pp. 381–388, 2001.
[10] S. G. Newman, “Microsporidian Impacts shrimp production – industry efforts address control, not eradication.,” Glob Aquac Advocate.16-17(March/April), 2015.
[11] J. E. Smith, “The ecology and evolution of microsporidian parasites.,” Parasitol, vol. 136, pp. 1901–1914, 2009.
[12] K. K. Rajendran, K.V., Shivam, S., Ezhil Praveena, P. Sahaya Rajan, J.J., Sathish Kumar, T. Satheesha Avunje., Jagadeesan, V., Prasad Babu, S.V.A.N.V., Ashish Pande. Navaneeth Krishnan, A., Alavandi, S.V. and Vijavan, “Emergence of Enterocytozoon hepatopenaei (EHP) infarmed Penaeus (Litopenaeus) vannamei in India.,” Aquaculture, vol. 454, pp. 272–280, 2017.
[13] S. Kmmari, S. Rathlavath, D. Pillai, and G. Rajesh, “Hepatopancreatic Microsporidiasis (HPM) in Shrimp Culture: A Review,” Int. J. Curr. Microbiol. Appl. Sci., vol. 7, no. 1, pp. 3208–3215, 2018.
[14] L. F. Aranguren, J. E. Han, and K. F. J. Tang, “Enterocytozoon hepatopenaei (EHP) is a risk factor for acute hepatopancreatic necrosis disease (AHPND) and septic hepatopancreatic necrosis (SHPN) in the Pacific white shrimp Penaeus vannamei,” Aquaculture, vol. 471, pp. 37–42, 2017.
[15] H. and W. L. Shen, H., Jiang, G., Wan, Xihe, Fan, Xianping Qiao, Y., Shi, Wenjum, Li, “Multiple Pathogens Prevalent in Shrimp Penaeus vannamei Cultured from Greenhouse Ponds in Jiangsu Province of China.,” J Aquac Res Dev., vol. 8, no. 10, pp. 1–5, 2017.
[16] B. Tang, K.F.J., Han, J.E., Aranguren, L.F., WhiteNoble, B., Schmidt, M.M., Piamsomboon P., Risdiana, E. and Hangogono, “Dense populations of the microsporidian Enterocytozoon hepatopenaei (EHP) in feces of Penaeus vannamei exhibiting white faeces syndrome and pathways of their transmission to healthy shrimp. Journal of invertebrate pathology,” J. Invertebr. Pathol., vol. 140, pp. 1–7, 2016.
Bài viết đã được UV-Việt Nam mua tác quyền từ tác giả, bất cứ hình thức sao chép nào đều phải có trích dẫn nguồn từ Công ty Cổ Phần UV

 Facebook
Facebook  Youtube
Youtube 








---anh-bia-01-3867.png)